FDA批准适应症
肺癌
单药适用于转移性伴有PD-L1高表达(由FDA获批的检测方法测出肿瘤PD-L1表达比例评分(TPS)≥ 50%)的非小细胞肺癌患者的线一治疗,这些患者不携带EGFR或ALK肿瘤基因变异。
联合培美曲塞和卡铂适用于转移性非鳞状细胞非小细胞肺癌患者的一线治疗,该治疗方案的应用是基于肿瘤反应率和无进展生存期而加速获批。此治疗方案持续的获批可能会根据确认试验的结果验证与临床获益而有所变更。
单药适用于转移性伴有PD-L1表达(由FDA获批的检测方法测出PD-L1表达比例评分(TPS)≥1%)的非小细胞肺癌患者,且使用铂类化疗药物之后出现疾病进展的患者。存在EGFR或ALK肿瘤基因变异的患者必须是在使用FDA获批的治疗后出现疾病进展方可考虑使用。
头颈部癌
适用于复发性或转移性头颈部鳞状细胞癌(HNSCC)患者的治疗,这些患者为接受铂类化疗药物后或治疗过程中出现疾病进展。该治疗方案的应用是基于肿瘤反应率和反应持久性而加速获批。此治疗方案持续的获批可能会根据确认试验的结果验证与临床获益而有所变更。
经典霍奇金淋巴瘤
用于治疗难治性经典型霍奇金淋巴瘤(cHL),或是接受三线治疗/三线治疗以上后复发的患者。该治疗方案的应用是基于肿瘤反应率和反应持久性而加速获批。此治疗方案持续的获批可能会根据确认试验的结果验证与临床获益而有所变更。
黑色素瘤
适用于不可切除或转移性的黑色素瘤患者的治疗。
尿路上皮癌
适用于不能接受含铂化疗的局部晚期或转移性尿路上皮癌的治疗。该适应症是以及肿瘤反应率及反应持久性加速获批。此治疗方案持续的获批可能会根据确认试验的结果验证与临床获益而有所变更。
适用于含铂化疗后进展或含铂新辅助/辅助化疗后12月内进展的局部晚期或转移性尿路上皮癌的治疗。
MSI-H(微卫星高度不稳定)癌
适用于成人及儿童无法手术切除或转移性MSI-H或dMMR(基因错配修复缺陷)实体瘤的治疗。实体瘤患者为先前治疗后进展,且无满意替代治疗选择,或为接受氟嘧啶、奥沙利铂及伊立替康治疗进展的结直肠癌患者。该治疗方案的应用是基于肿瘤反应率和反应持久性而加速获批。此治疗方案持续的获批可能会根据确认试验的结果验证与临床获益而有所变更。
使用限制:尚缺乏在儿童MSI-H中枢神经系统肿瘤的使用安全性及有效性数据。
在特殊人群中的使用
• 孕妇:基于的作用机制,可能会对孕妇的胎儿产生危害。若怀孕期间患者使用该药或是患者在使用该药时怀孕,则可能会对患者的胎儿造成危害。建议育龄期女性患者接受治疗期间以及使用最后一剂后的四个月内使用高效的避孕措施。
• 哺乳妇女: 尚未知人类母乳是否会分泌。目前无任何有关是否对人类母汁分泌或是对人类母乳所产生影响的评估研究,由于许多药物会从人类母乳分泌,因此使用治疗期间以及使用最后一剂后四个月内的妇女请务必停止哺乳。
• 儿童: 儿童患者使用的临床经验有限。有一项研究,当中包括40名晚期黑色素瘤、PD-L1阳性/复发性/难治性的实体瘤或淋巴瘤儿童患者。该研究的患者进行了中位数43天(范围1天到414天)的治疗,其中24名患者(60%)进行了大于或等于42天的治疗。对于儿童患者的安全性与成人患者的安全性相近。儿童患者与65岁以下的成人患者比较毒性时,在以下项目中所显示的概率较高(≥15%的差异):疲劳(45%)、呕吐(38%)、腹痛(28%)、高转氨酶血症(28%)、低血钠症(18%)。
• 65岁以上人群: 临床研究中一共3355名患者接受了治疗,这些患者包括黑色素瘤患者、非小细胞肺癌患者、或经典型霍奇金淋巴瘤患者,其中65岁以上的患者占41%,75岁以上的患者占12%。总体上,老年患者与年轻患者之间在安全性或有效性上不存在太大的差异。
治疗期间开始治疗
• /转移性非小细胞肺癌 & HNSCC/头颈部鳞状细胞癌&尿路上皮癌:200mg,每3周1次。
• 黑色素瘤: 2 mg/kg ,每3周1次。
• 经典型霍奇金淋巴瘤&MSI-H癌:成人200mg,每3周1次; 儿童按照2mg/kg (最大200 mg)每3周1次。
• 转移性非小细胞肺癌、头颈部鳞状细胞癌、经典型霍奇金淋巴瘤、尿路上皮癌、MSI-H癌:治疗应持续直至疾病进展或出现不可耐受的毒性作用,或无疾病进展时持续用药24个月。
• 晚期黑色素瘤:治疗应持续直至疾病进展或出现不可耐受毒性作用。
• 当联合卡铂/培美曲塞方案用药时,应在卡铂/培美曲塞用药当天在化疗开始之前给药。化疗部分参考卡铂和培美曲塞的用药说明。
实验室检测
• 治疗的开始及治疗期间,周期性监控患者的实验室检查指标,以及根据临床评估提示进行实验室检查。
若实验室检查指标出现异常,排除其他原因并根据药品处方信息进行治疗管理。
不良反应监控
对于怀疑免疫介导的不良反应,确保足够的评估以确认病因或排除其他原因。根据不良反应的不同严重程度,停用并使用皮质激素治疗。请参见第8-11页不同级别不良反应处理推荐意见。

治疗期间不良反应管理
如果怀疑你的患者出现不良反应,评估确认病因或排除其他原因。根据不良反应的严重程度,暂缓或终 止治疗并给予皮质激素治疗,推荐如下。


不良反应分级定义是根据美国癌症研究所-不良反应常见术语标准 (NCI-CTCAE)v4.03进行定义。 不良反应按照出现的概率有高至低进行排序。
AST=谷草转氨酶;ALT=谷丙转氨酶; ULN=正常值上限。
治疗报道的不良反应
• 在3项随机、开放、活性对照的临床试验当中,评估2799名患者使用药物的安全性,其中有912名无法手术切除/转移性的黑色素瘤患者,682名转移性非小细胞肺癌,以及一项总共有655名无法手术切除/转移性黑色素瘤患者和550名转移性非小细胞肺癌患者的单药临床试验。此外,下表所提供的信息也反映非随机、开放、多队列的临床试验,当中有192名头颈部鳞状细胞癌患者,和241名经典霍奇金淋巴瘤患者(在2项非随机、开放的临床试验)。在所有研究中,的常规使用方式为每3周静注剂量2mg/kg(Q3W),每2周静注剂量10mg/ kg(Q2W),静注10mg/kg Q3W,或静注200mg Q3W。
临床试验合并统计部分免疫介导不良反应的发生情况
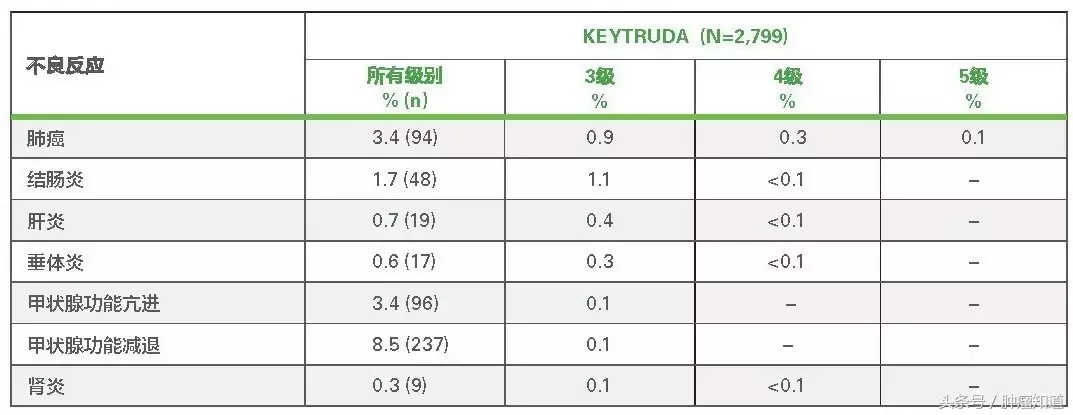
• 头颈部鳞状细胞癌患者会出现或是原有情况加重的甲状腺功能亢进的可能性相对较高,使用的192名患者中,有28名(15%)患者出现甲状腺功能亢进,包括3级甲状腺功能亢进(0.5%)。在这28名患者中,有15名既往无甲状腺功能亢进史。
• 使用的2799名患者当中,有16名(0.6%)出现甲状腺炎,包括2级甲状腺炎(0.3%)。
• 使用的2799名患者当中,有6名(0.2%)出现免疫介导性1型糖尿病(包括糖尿病酮酸中毒)。
• 临床上较严重的免疫介导性不良反应在使用的2799名患者当中发生的概率小于1%(除非另有说明),这些不良反应包括:关节炎(1.5%)、剥脱性皮炎、大疱性类天疱疮、皮疹(1.4%)、葡萄膜炎、肌炎、格林巴利综合征、重症肌无力、脉管炎、胰腺炎、溶血性贫血、和1名脑实质具炎性灶的患者发生部分性癫痫。此外,其他的临床试验当中也有患者发生骨髓炎和心肌炎,其中包括经典型霍奇金淋巴瘤患者和上市后使用的患者。
• 若疑似发生免疫介导性反应,请确保适当评估病因或是排除其他原因。根据不良反应的严重性,可考虑暂停或是永久停用并使用皮质类固醇激素。
• 上市后使用的患者有出现实体器官移植排异反应。治疗可能会增加产生实体器官移植排斥反应的风险。因此,患者需要在的治疗获益上与器官排斥反应的风险上进行审慎衡量评估。
• 使用的2799名患者当中,有6名(0.2%)患者发生严重或危及生命的输注相关的反应。
• 接受治疗后进行异基因造血干细胞移植的患者可能会发生免疫介导性并发症(包括致死事件)。在任何临床试验中接受治疗后进行异基因造血干细胞移植的23名经典型霍奇金淋巴瘤患者中有6名(26%)患者出现移植物对抗宿主疾病(其中1名患者致死),2名患者(9%)在降低强度调节后患上严重的肝静脉闭塞病(其中1名患者致死)。另外,有移植前使用PD-1受体阻断抗体的淋巴瘤患者进行异基因造血干细胞移植后出现致死性的超急性移植物抗宿主病。尽管对PD-1 抑制剂和异基因造血干细胞移植进行干预治疗,这些并发症依然可能发生。请严密监控患者,早期发现是否存在与移植相关的并发症,包括:超急性移植物抗宿主病、重症急性移植物抗宿主病(3级到4级)、激素依赖性发热综合征、肝静脉闭塞病、和其他免疫介导性不良反应,且立即干预治疗。
• -006试验中,由于555名晚期黑色素瘤患者当中有9%的患者发生不良反应,并因此停用,这些超过1名患者所发生的不良反应包括结肠炎(1.4%)、自体免疫性肝炎(0.7%)、过敏反应(0.4%)、多发性神经病(0.4%)、心脏衰竭(0.4%)。21%的患者会发生所造成的不良反应;最常见的(≥ 1%)是腹泻(2.5%)。 vs 伊匹单抗的几个最常见的不良反应包括:疲劳(28%vs 28%)、腹泻( 26%)、皮疹(24% vs 23%)、恶心( 21%)。针对使用伊匹单抗后所出现的不良反应发生率若小于/等于使用后所产生的不良反应,即会列出其相应发生率。
• -002中,357名的晚期黑色素瘤患者当中有12%的患者因出现不良反应而停用;最常见的(≥ 1%)的反应包括:整体身体状态恶化(1%)、衰弱(1%)、呼吸困难(1%)、肺炎(1%)、和全身性水肿(1%)。有14%的患者因为不良反应而导致中断的使用;最常见的(≥ 1%)的反应包括:呼吸困难(1%)、腹泻(1%)、和斑状丘疹(1%)。 vs 化疗最常见的不良反应包括:疲劳( 43%)、瘙痒症(28% vs 8%)、皮疹(24% vs 8%)、便秘(22% vs 20%)、恶心( 22%)、腹泻(20% vs 20%)、食欲下降( 20%)。针对使用化疗后所出现的不良反应发生率若小于/等于使用后所产生的不良反应,即会列出其相应发生率。
• 682名转移性非小细胞肺癌患者中有8%的患者因为不良反应而停用单药治疗。导致永久停用的最常见的不良反应包括:肺炎(18%)。23%的患者因为不良反应而中断使用;最常见(≥ 1%)的反应包括:腹泻(1%)、疲劳(1.3%)、肺炎(1%)、肝酶值上升(1.2%)、食欲下降(1.3%),和肺炎(1%)。最常见的不良反应(至少20% 的患者出现过这些不良反应且发生率高于使用多西他赛)包括:食欲下降(25% vs 23%)、呼吸困难(23% vs 20%)、以及恶心(20% vs 18%)。
• 当联合卡铂和培美曲塞使用时,59名患者当中有10%名患者停用。最常见(≥ 2%)会导致停用的不良反应是急性肾受损(3.4%)。有39%的患者由于不良反应而中断使用;最常见(≥ 2%)的反应包括:疲劳(8%)、中性粒细胞计数下降(8%)、贫血(5%)、呼吸困难(3.4%)、和肺炎(3.4%)。使用联合化疗 vs 单独卡铂和培美曲塞化疗所产生的最常见(≥ 20%)的不良反应包括:疲劳(71% vs 50%)、恶心(68% vs 56%)、便秘(51% vs 37%)、皮疹(42% vs 21%)、呕吐(39% vs 27%)、呼吸困难(39% vs 21%)、腹泻(37% vs 23%)、食欲下降(31% vs 23%)、头痛(31% vs 16%)、咳嗽(24%vs 18%)、头晕(24% vs 16%)、失眠(24% vs 15%)、瘙痒症(24% vs 4.8%)、外周性水肿(22% vs 18%)、味觉障碍(20% vs 11%)、秃头症(20% vs 3.2%)、上呼吸道感染(20% vs 3.2%)、和关节痛(15% vs 24%)。该研究的目的并非为了证明使用联合化疗 vs 单独卡铂和培美曲塞化疗所产生的不良反应存在明显统计学差异。
• 192名头颈部鳞状细胞癌患者中有17%的患者由于不良反应而停用。当中有45%的患者出现严重的不良反应。至少2%的患者会出现的最频繁的严重不良反应包括:肺炎、呼吸困难、意识模糊状态、呕吐、胸腔积液、和呼吸性衰退。最常见(至少20%的患者出现过)的不良反应包括:疲劳、食欲下降、和呼吸困难。总体看来,头颈部鳞状细胞癌患者所出现的不良反应与黑色素瘤患者或非小细胞肺癌患者会出现的不良反应相似,除了脸部水肿(所有级别占10%;3级或4级占 2.1%)和新发/恶化的甲状腺功能减退。
210名经典霍奇金淋巴瘤患者中有5%的患者由于不良反应而停用,有26%的患者由于不良反应而中断治疗。有15%的患者出现的其中一个不良反应需要系统性的皮质类固醇治疗。有16%的患者出现严重的不良反应。最常见的(≥ 1%)不良反应包括:肺炎、发烧、呼吸困难、移植物抗宿主病、带状疱疹。有2名患者由于疾病进展以外的原因而死亡;其中一名患者是在进行异基因造血干细胞移植后死于移植物抗宿主病,另一名患者死于败血性休克。最常见的不良反应(≥ 20%的患者会出现的反应)包括:疲劳(26%)、发烧(24%)、咳嗽(24%)、肌骨骼疼痛(21%)、腹泻(20%)、和皮疹(20%)。
-052中,共有370名局部晚期或转移性尿路上皮癌患者,患者无法耐受含铂化疗。最常见的不良反应(报道超过20%的患者出现)为乏力、肌肉骨骼疼痛、食欲下降、便秘、皮疹和腹泻。有11%的患者因不良反应停用。18名(5%)患者因疾病进展以外的原因死亡。5名(1.4%)接受治疗的患者出现脓毒血症导致死亡,另外3名(0.8%)的患者因肺炎导致死亡。不良反应导致22%的患者使用出现中断;最常见的原因(1%)包括肝酶升高、腹泻、尿路感染、急性肾功能损伤、乏力、关节痛及肺炎。严重不良反应出现在42%的患者中。最常见的严重不良反应(2%)为尿路感染、血尿、急性肾损伤、肺炎及尿脓毒症。
在-045中,有266名尿路上皮癌患者接受治疗,其中有8%的患者因不良反应停用。最常见的导致永久停用的不良反应为肺炎(1.9%)。不良反应导致20%的患者用药中断。其中最常见(发生率大于1%)的原因为尿路感染(1.5%)、腹泻(1.5%)及结肠炎(1.1%)。最常见的不良反应(出现在20%以上接受治疗的患者中)为乏力、肌肉骨骼疼痛、皮疹、食欲下降、恶心、皮疹。严重不良反应出现在39%的接受治疗的患者中。其中最常见的治疗相关严重不良反应(发生率≥2%)为尿路感染、肺部感染、贫血及肺炎。
在统计的86例接受单药治疗患者中,74%的患者出现了不良反应,多数为低级别不良反应,其中21%患者出现甲状腺功能低下的内分泌障碍,通过甲状腺激素替代治疗控制。
支持(这部分仅适用于美国地区)
The Merck for
The Merck on:
• and
•Co-pay for
•Bene t
•Prior and
•
You can also to by a .
———END———
限 时 特 惠: 本站每日持续更新海量各大内部创业教程,永久会员只需109元,全站资源免费下载 点击查看详情
站 长 微 信: nanadh666



